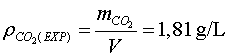El pes dels gasosEstem acostumats, de sempre, a pesar les coses amb una balança. Ara bé, podem utilitzar-la per pesar gasos? Veurem que sí, sempre que prenguem en consideració factors que habitualment no tenim en compte. Podem pesar butà, CO2 , hidrogen... Això ajudarà els alumnes d'ESO a considerar els gasos com una substància "real" . Els de batxillerat ho podran relacionar amb l'assignatura de química i treballar la llei dels gasos ideals.  
Guia del professorat
Material
- balança electrònica de 0,01g
de sensibilitat
- ampolles buides de 1,5
L (també ho podem fer amb
0,5 L)
- suport i pinça
- matràs d'erlenmeyer
- tap foradat, tubs de vidre i tub de goma
- àcid clorhídric
- carbonat de calci (que no sigui en pols)
- zinc o alumini
Procediment
Primera part: 
Es tracta de generar 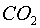 amb alguna reacció química, per exemple amb carbonat de
calci i àcid clorhídric. Aquest
amb alguna reacció química, per exemple amb carbonat de
calci i àcid clorhídric. Aquest 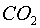 el posarem dins d'una ampolla de plàstic. Cal generar un volum
de gas bastant superior al de l'ampolla per tal d'aconseguir expulsar-ne
tot l'aire. Per a una ampolla d'1,5
L haurem de generar 0,15
mol de gas
el posarem dins d'una ampolla de plàstic. Cal generar un volum
de gas bastant superior al de l'ampolla per tal d'aconseguir expulsar-ne
tot l'aire. Per a una ampolla d'1,5
L haurem de generar 0,15
mol de gas
1) Posem 15
g de carbonat de calci (per exemple, trossos de marbre) dins de
l'erlenmeyer
2) Preparem 75
mL de 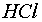 ,
4 mol/L aproximadament. ,
4 mol/L aproximadament.
3) Posem una ampolla d'1,5
L destapada, buida i seca, damunt la balança. Tarem
per posar a zero la balança ( vegeu la figura 1).
4) Un colze de vidre travessa el tap de l'erlenmeyer
i està unit per un tub de goma a un tub de vidre que entra en l'ampolla
sense tocar-la. aquest tub de vidre cal subjectar-lo amb una pinça
unida a un suport metàl·lic. Convé que el tub que
entra a l'ampolla sigui una mica llarg i baixi 10
o 15 cm dins
l'ampolla
5) Tirem el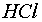 dins de l'erlenmeyer i el tapem ràpidament
dins de l'erlenmeyer i el tapem ràpidament
6) La indicació de la balança comença
a pujar. Al cap d'uns quants minuts, s'estabilitza
7) Llegim la indicació final. Amb això,
calcularem el pes del 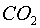 (o la seva massa)
(o la seva massa)
8) Si al final traiem el tub i tapem l'ampolla, podrem
utilitzar el 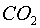 per fer algun experiment qualitatiu.
per fer algun experiment qualitatiu. |
 |
Càlculs
La balança mesura la massa aparent 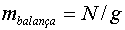 ,
on N
és la normal, que quan la balança està en equilibri
(vegeu la figura 2) serà igual a: ,
on N
és la normal, que quan la balança està en equilibri
(vegeu la figura 2) serà igual a:
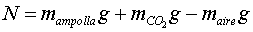
és a dir, al pes real de tot l'objecte menys l'empenyiment d'Arquimedes,
a causa de l'aire que l'envolta.
La massa de 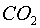 és: és:
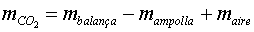
Una manera habitual de procedir és tarar la balança
per no anar arrossegant tota l'estona la massa de l'ampolla, tal com s'indica
al punt 3. Fer això equival a considerar 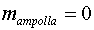 .
En aquest cas tindrem .
En aquest cas tindrem
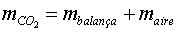
Mirem-ho d'una altra manera: hem substituït aire per
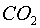 ; per tant, a
la massa indicada per la balança hi hem d'afegir la massa de l'aire
que ha marxat. ; per tant, a
la massa indicada per la balança hi hem d'afegir la massa de l'aire
que ha marxat.
Utilitzarem la llei dels gasos ideals per calcular la massa de l'aire:
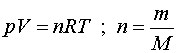
|
 |
recordem que n
és el nombre de mols, m
la massa de gas i M
la massa d'un mol de gas. Podem aïllar la massa i escriure
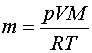
Aplicat al nostre cas, en què V
= 1,5 L, 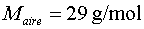 ,T
= 20ºC = 293 K i p=1,00
atm (o la temperatura i pressió que hi hagi al laboratori) ,T
= 20ºC = 293 K i p=1,00
atm (o la temperatura i pressió que hi hagi al laboratori)
Amb això 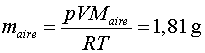
i finalment 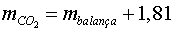 , en
gram. , en
gram.
Si dividim aquesta massa entre el volum de l'ampolla, podrem trobar la densitat
experimental del 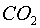 , ,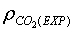 ,
i comparar-la amb la teòrica ,
i comparar-la amb la teòrica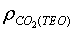 : :
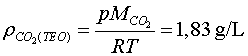 . .
En l'experiment que hem fet nosaltres (vegeu la figura 2) 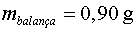 ,
per tant, ,
per tant,
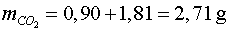 ; ; 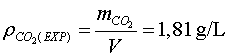
així hi ha una discrepància entre els dos valors al voltant del
1%.
Càlculs
igual que abans
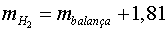 , en gram. , en gram.
En el nostre cas tenim ( vegeu la figura 4) 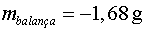
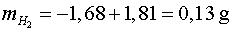
que ens dóna una densitat experimental de 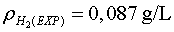 quan la teòrica és
quan la teòrica és 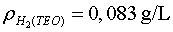
amb una discrepància del 5%
entre els dos resultats. Convé observar que la massa de l'hidrogen
és una quantitat petita obtinguda per diferència entre dues
de molt més grans. Per tant, un petit error en el que realment
mesurem amb la balança (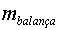 )
es converteix en un error gran en la diferència ( )
es converteix en un error gran en la diferència (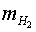 )
)
|
 |
Tercera part: experiències qualitatives
Per acabar, podem fer unes experiències qualitatives
(per l'ESO) amb aquests gasos, per exemple:
1) Posem una espelma encesa dins d'un vas de precipitats
gran. Posem un embut damunt del vas. Tirem a l'embut el 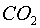 que havíem guardat a l'ampolla, cau dins del vas i apaga l'espelma.
És a dir, el
que havíem guardat a l'ampolla, cau dins del vas i apaga l'espelma.
És a dir, el 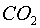 cau a través de l'embut tal com ho faria un líquid ( vegeu
el video de la figura 5)
cau a través de l'embut tal com ho faria un líquid ( vegeu
el video de la figura 5)
2) Si fem la reacció de l'hidrogen en un Kitasato
(parets més gruixudes) i el tapem, podrem inflar globus amb hidrogen
utilitzant la sortida lateral
3) També podem obrir un encenedor o un fogonet
damunt d'un vas situat damunt d'una balança. La indicació
augmentarà.
4) Per treballar més aquest tema, vegeu també
l'article El
pes de l'aire, de Pere Quintana i Montserrat Vallès,
pùblicat a Recursos de física,
al número de Primavera de 2010 (http://www.xtec.cat/rrfisica/num5/article_num=20&pos=6&total=9&art=74.html)
|

|
|

 7/9
7/9 



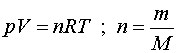

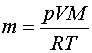
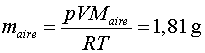
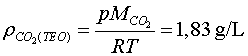 .
.